当前位置:首页 → 职业资格 → 教师资格 → 中学化学学科知识与教学能力->根据下列材料,按要求完成任务。材料一《普通高中化学课程标准(
根据下列材料,按要求完成任务。
材料一《普通高中化学课程标准(实验)》关于“非金属及其化合物”的内容标准:通过实验了解氯、氮、硫、硅等非金属及其重要化合物的主要性质.认识其在生产中的应用和对生态环境的影响.?
材料二某版本教科书《化学l》的知识结构体系?
第一章从实验学化学?
第二章化学物质及其变化?
第三章金属及其化合物?
第四章非金属及其化合物?
第一节无机非金属材料的主角——硅?
第二节富集在海中的元素——氯?
第三节硫和氮的氧化物?
第四节氨硝酸硫酸?
材料三某版本高中实验教科书《化学1》中“活泼的黄绿色气体——氯气”的片段:?

氯气的发现和确认?

1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热.产生了一种黄绿色的气体,有强烈的刺鼻气味。舍勒对这种气体进行了研究,但他受当时流行的学说…一一燃素说(后来证明是错误的)的影响。未能确认这种气体的“庐山真面目”。后来的研究者又被当时得到广泛认同的“一切酸中舍有氧”的观点所束缚。认为舍勒制得的黄绿色气体是“氧化的盐酸”气——一一种氧化物。英国化学家戴维曾通过多种实验想把“氧化的盐酸”,中的“氧”夺取出来,但都未能实现。直到1810年,戴维以大量实验事实为根据,确认“氧化的盐酸”不是一种化合物,而是一种新元素组成的单质,他将这种元素命名为chlorine。这一名称来自希腊文.有“绿色”的意思。中文译名曾为“绿气”,后改为“氯.气.”。
图4-14?瑞典化学家——舍勒(C.?W..Seheele.?1742——1786)

阅读科学史话“氯气的发现和确认”.并思考:?
1.从氯气的发现到确认为一种新的元素.时间长达三十多年。你从这一史实中得到什么启示?
2.舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。请写出舍勒发现氯气的化学反应方程式:?
氯气(Cl2)在通常情况下呈黄绿色,是一种有强烈刺激性气味的有毒气体。与其他气体一样,氯气在低温和加压的条件下可以转变为液态(称为液氯)和固态。氯气是很活泼的非金属单质,具有很强的氧化性。氯气能与大多数金属化合。生成金属氯化物(盐)。例如.钠、铁、铜等都能在氯气中燃烧:?
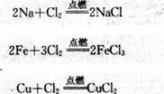
氯气也能与大多数非金属化合。

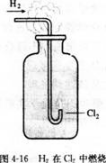
实验4-3
在空气中点燃H2.然后把导管缓缓伸入盛满氯气的集气瓶中。观察现象。

H2与Cl2化合的产物HCl气体溶于水,就成为我们常用的盐酸。

目前,很多自来水厂用氯气来杀菌、消毒,我们偶尔闻到的自来水散发出来的刺激性气味就是余氯的气味。
氯气溶于水为什么能杀菌消毒呢?在25℃时.1体积的水可溶解约2体积的氯气.氯气的水溶液称为氯水。在常温下,溶于水中的部分Cl2与水发生如下反应:
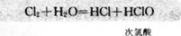
次氯酸(HClO)具有强氧化性,因此。次氯酸能杀死水中的病菌.起到消毒的作用。
氯水也因为含有次氯酸而具有漂白作用。
次氯酸是很弱的酸,不稳定,只存在于水溶液中,在光照下易分解放出氧气:?

近年来有科学家提出,使用氯气对自来水消毒时,氯气会与水中的有机物发生反应,生成的有机氯化物可能对人体有害。因此.人们已开始研究并试用新的自来水消毒剂,如二氧化氯(ClO2)、臭氧等。

氨水的漂白作用?
将有色纸条或布条、有色花瓣放入盛有1/3容积新制氯水的广口瓶中.盖上玻璃片。
观察现象。


干燥的氯气能否漂白物质?
持有色纸条或布条、有色花瓣放入盛满于燥氯气的集气瓶中,盖上玻璃片。观察现象。
 ?
?
最初,人们直接用氯气作漂白剂,但因氯气的溶解度不大.而且生成的HClO不稳定,难以保存,使用起来很不方便,效果也不理想。在Cl2与水反应原理的基础上,经过多年的实验、改进,才有了今天常用的漂白液和漂白粉。
在常温下.将氯气通人NaOH溶液中可以得到以次氯酸钠(NaCIO)为有效成分的漂白液。其化学反应方程式如下:?


氯气是一种有毒气体。但可用于自来水的杀菌消毒:使用氯气对自来水消毒时可能产生一些负面影响。因此,人们开始研究并试用一些新型自来水消毒剂。从中你得到什么启示?
要求:?
(1)简要分析教材中该内容的地位和作用。
(2)写出本课的三维教学目标。
(3)设计本节内容的教学过程。
(1)氯是比较典型的非金属元素,氯及氯的化合物在日常生活、工农业生产中的应用非常广泛。对氯气性质、用途和制法的研究,不仅是下一节进一步学习、研究卤素性质相似性及其变化规律的需要.也是研究同族元素性质变化规律的需要。由于高中阶段氯气的性质、用途应用较多,对学生全面认识化学元素、形成正确观点、掌握正确学习方法等有重要作用.
(2)教学目标
知识与技能:通过实验观察了解氯气的物理性质和用途.掌握氯气的化学性质。
过程与方法:①通过观察、分析实验现象,培养观察和分析问题的能力;②了解物质性质探究的一般方法——实验探究法;③在学习中,学会运用观察、实验、查阅资料等多种手段获取信息。并运用比较、分类、归纳、概括等方法对信息进行加工。
情感态度与价值观:通过学习,认识到海水是人类宝贵的自然资源。培养与大自然友好相处的情感:联系生活体会氯气给生活带来的变化.培养学习化学的兴趣。
(3)教学过程
导入新课:在日常生活中我们接触的很多东西都涉及氯元素,例如我们输液时的生理盐水.自来水的杀菌消毒都有氯元素的参与。从这节课开始,我们就来学习有关氯及其化合物的知识.
引入:多媒体课件展示与氯气有关的图片.
1.第一次世界大战德军使用氯气;2.京沪高速公路淮安段氯气泄露事件.
学生活动:观看多媒体课件.初步了解和感受氯气的危害.
设问:氯气是怎样被发现的呢
学生活动:学生自主阅读“科学史话”,并写出舍勒发现氯气的化学方程式。
过渡:氯气究竞是一种怎样的物质呢 下面我们就来研究这种气体物质.
展示:向学生展示一瓶刚制备好的氯气.
引导探究:教师引导学生观察、讨论氯气颜色、状态、气味。
设问:闻氯气的正确方法是怎样的
演示:闻氯气时应该用手轻轻地在瓶口扇动,使极少量的氯气飘进鼻孔.
板书:1.氯气的物理性质
黄绿色有毒气体,有刺激性气味,可溶于水(1:2),密度比空气大,熔、沸点较低。易液化。
问题探究:假如你是一名士兵,当遇到由氯气制成的毒气弹顺风爆炸时.你认为可采用哪些措施进行防御
学生回答:1.人躲向地势较高的地方去:2.防毒面具。
过渡:初中我们学习过原子结构示意图的画法,下面请同学们画出氯原子的结构示意图.并借此推测氯原子的性质。
学生活动:学生画出氯的原子结构示意图,通过氯的原子结构推测氯原子性质。
分析:氯原子最外层有7个电子,易得一个电子,使最外层达到8个电子的稳定结构.具有强氧化性。
讲述:结构决定性质,氯原子很活泼,易与另一个原子结合成双原子分子,其单质的性质非常活泼.具有极强的氧化性。下面我们来学习氯气的化学性质.
板书:2.氯气的化学性质
讲述:氯气可以与活泼的金属钠反应,还可以与不太活泼的金属反应.如FeCu等也能在氯气中燃烧生成

设问:氯气可以与金属发生反应,那么氯气能不能与氢气发生反应呢

总结:燃烧不一定要有氧气参加,物质并不是只有在氧气中才可以燃烧,任何发光发热的剧烈化学反应都可以叫燃烧.燃烧的本质是氧化还原反应。
板书:(2)与非金属反应

讲述:实验证明,在一定的条件下,Cl2还可以和P等非金属发生反应。
过渡:你是否偶尔碰到过这样的情形:有时打开水龙头会闻到一股刺激性的气味,你想过这是什么原因吗
设问:氯气是一种有毒的气体,自来水厂为什么还用氯气来杀菌消毒 氯气溶于水为什么能杀菌消毒呢
学生活动:学生讨论提出初步猜想。
实验探究:氯气是否与水发生反应 如果发生了反应一定有新物质生成。我们把氯气溶于水所得的水溶液称为氯水.新制氯水中的成分究竟是什么
学生活动:教师提供仪器和药品(试管2支、胶头滴管2支、新制氯水、紫色石蕊试液、硝酸银溶液、稀硝酸等).学生进行分组实验.通过分组实验验证猜想。
预设方案:验证1:观察氯水论证Cl2分子。
验证2:用紫色石蕊试液测氯水的酸碱性。
验证3:用硝酸银溶液和稀硝酸来检验氯离子。
学生活动:观察实验现象,小组分析讨论,得出结论。
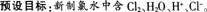
延伸探究:在同学们进行的分组实验中,滴加氯水后石蕊试液为什么先变红后又褪色了呢 是否是Cl2具有漂白性呢
补充实验:取一张红纸,湿润一半投入干燥氯气中。
实验现象:纸条干燥处没有褪色.纸条湿润处褪色了。
师生互动:共同讨论.教师指导,得出结论。
总结:干燥的氯气并无漂白性,真正具有漂白性的物质(使石蕊褪色的物质)不是氯气而是一种新的物质,
讲述:次氯酸具有很强的氧化性.Cl2通入水中会生成次氯酸,能起到杀菌消毒的作用。但同时次氯酸又是很弱的酸.不稳定.只存在于水溶液中.在光照下容易分解。
实验演示:次氯酸光照分解。
讲述:由于Cl2的溶解度不大,而且生成的HClO不稳定,难以保存,使用起来很不方便,效果也不理想。在Cl2与水反应原理的基础上.经过多年的实验、改进,才有了今天常用的漂白粉和漂白液。那么,它们是怎样制得的呢 这个问题我们留到下节课再来进行讨论。
板书设计:
氯气的性质
1.氯气的物理性质
黄绿色有毒气体,有刺激性气味,可溶于水(1:2),密度比空气大,熔、沸点较低,易液化。
2.氯气的化学性质
教学过稈具冇哪些基木特点?
简述开展好课外活动的基木要求。
开展好课外活动的基木要求:
简要冋答少年儿童的身心发展的个別差异性。
班主任要统一各方而的___________ ,同家庭与社会密切配合。
小学德育的基木途径是______________ 。
课的类型大致可分为________ 和_________ 两大类。
学生是生活在一定的社会关系中,具冇特定的_________的人。
师生在人格上是_________ 的关系。
德育的个体功能可以描述为德育对个体生存、发展、________ 发生影响的三个方而。
教学工作的基木环节包括_______ 、______、______、_______和______五个方而。