化学兴趣小组对CO2与NaOH溶液反应的发生进行了探究。
(1)从压强变化的角度探究。
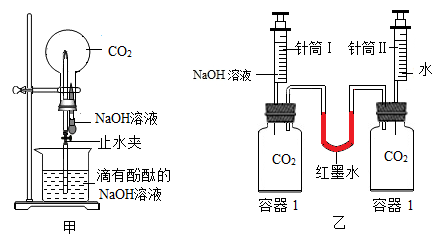
①利用图甲装置进行实验,先挤压胶头滴管,再打开止水夹,观察到烧瓶内形成红色“喷泉”,原因是烧瓶内压强 (填“大于”或“小于”)外界大气压;
②利用图乙装置进行实验,分别将等体积的NaOH溶液和水同时注入盛有等体积CO2的玻璃容器中。证明CO2与NaOH溶液发生反应的实验现象是 ;
③写出CO2与NaOH溶液反应的化学方程式:。
(2)利用“数字化实验”探究。
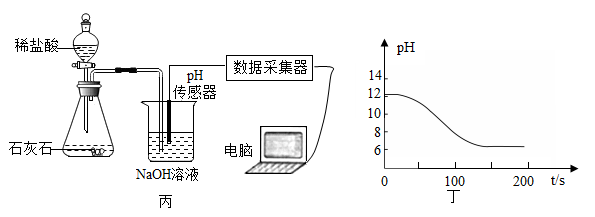
①写出图丙中制取CO2的化学方程式:,检验CO2的方法是 ;
②实验测得烧杯中溶液的pH随时间的变化关系如图丁所示,可推知反应过程中浓度不断减小的离子是 (填离子符号)。
(3)氯碱工业生产的烧碱样品中常含有Na2CO3和NaCl等杂质。为测定烧碱样品中Na2CO3的质量分数,称取20g烧碱样品,加足量水溶解,再加入足量的BaCl2溶液,充分反应后,过滤,将滤渣洗涤、干燥、称量,得到0.197g碳酸钡(BaCO3)固体。
①检验烧碱样品中是否含有Na2CO3,可选择的试剂是 (填字母);
a.稀盐酸
b.澄清石灰水
c.酚酞
②计算烧碱样品中Na2CO3的质量分数(写出计算过程)。

化学兴趣小组对CO2与NaOH溶液反应的发生进行了探究。
(1)从压强变化的角度探究。

①利用图甲装置进行实验,先挤压胶头滴管,再打开止水夹,观察到烧瓶内形成红色“喷泉”,原因是烧瓶内压强 (填“大于”或“小于”)外界大气压;
②利用图乙装置进行实验,分别将等体积的NaOH溶液和水同时注入盛有等体积CO2的玻璃容器中。证明CO2与NaOH溶液发生反应的实验现象是 ;
③写出CO2与NaOH溶液反应的化学方程式:。
(2)利用“数字化实验”探究。

①写出图丙中制取CO2的化学方程式:,检验CO2的方法是 ;
②实验测得烧杯中溶液的pH随时间的变化关系如图丁所示,可推知反应过程中浓度不断减小的离子是 (填离子符号)。
(3)氯碱工业生产的烧碱样品中常含有Na2CO3和NaCl等杂质。为测定烧碱样品中Na2CO3的质量分数,称取20g烧碱样品,加足量水溶解,再加入足量的BaCl2溶液,充分反应后,过滤,将滤渣洗涤、干燥、称量,得到0.197g碳酸钡(BaCO3)固体。
①检验烧碱样品中是否含有Na2CO3,可选择的试剂是 (填字母);
a.稀盐酸
b.澄清石灰水
c.酚酞
②计算烧碱样品中Na2CO3的质量分数(写出计算过程)。
氢气是一种可持续研发的新能源和工业原料。
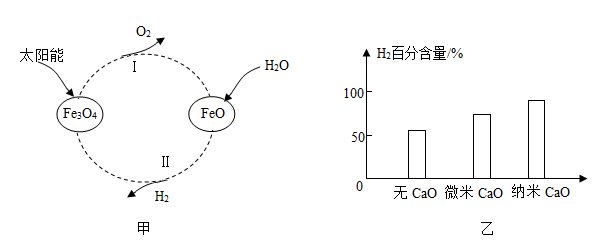
(1)利用太阳能将水转化为氢能是一种理想途径。某种光分解水的过程如图甲所示。
①该转化中循环利用的物质有Fe3O4和 (填化学式);
②与电解水相比,该方法的优点是 。
(2)CH2﹣H2O催化重整是目前大规模制取H2的重要方法,生产过程中涉及的重要反应有
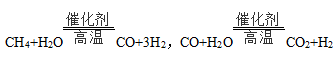
①向催化重整体系中投入一定量的CaO可提高H2的百分含量,原因是 ;
②如图乙所示,投入纳米CaO时,H2的百分含量最大的原因是 。
(3)氢气可用于钢铁冶炼、合成氨和合成甲醇等工业。写出赤铁矿(主要成分为Fe2O3)与氢气在高温下炼铁的化学方程式:。
家用燃料变迁过程的示意图如图:

(1)2020年,受新冠疫情的影响,全球工业生产排放的温室气体比2019年 (填“上升”或“下降”)。
(2)秸秆在隔绝空气的条件下受热分解生成H2、CH4和CO等气体,则秸秆中一定含有的元素有 ;煤炭燃烧时排放出NO2、等气体,在空气中会形成酸雨。
(3)由液化石油气(主要成分为C3H8)改为压缩天然气(主要成分为CH4)时,燃气报警器应安装在灶具的 (填“上方”或“下方”);写出CH4完全燃烧的化学方程式:。
(4)为实现我国“2030年前碳达峰,2060年前碳中和”的目标,你认为能源综合利用的趋势是 。
氮及其化合物的“价类二维图”如图所示。
(1)A点对应的物质可以是 (填字母)。
a.氮气
b.氧气
c.氢气
(2)B点对应物质的化学式是 (填字母)。
a.N2O
b.NO
c.N2O3
(3)NH3•H2O的物质类别是 (填字母)。
a.酸
b.碱
c.盐
(4)KNO3在图中对应的点是 (填字母)。
a.C
b.D
c.E

将0.72g草酸亚铁(FeC2O4)放在一个可称量的敞口容器中高温焙烧,500~600℃时,容器中的固体质量保持0.4g不变。所得物质的化学式为( )
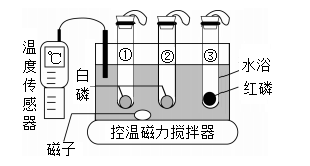
利用如图装置进行燃烧条件的探究。试管①中充满氮气,试管②③中充满氧气,升温至40℃,仅观察到②中的白磷燃烧。下列叙述错误的是( )
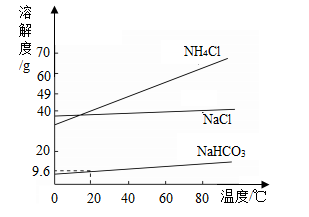
“侯氏制碱法”生产纯碱的主要反应是NaCl+NH4HCO3═NaHCO3↓+NH4Cl。如图是三种物质的溶解度曲线。下列叙述正确的是( )
下列叙述正确的是( )
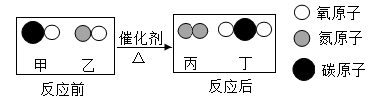
如图是甲和乙在一定条件下反应前后分子种类变化的微观示意图。下列叙述正确的是( )
下列物质的性质与用途对应关系正确的是( )