某厂排放的废水中含有碳酸钠,易造成环境污染。化学兴趣小组为该厂设计废水处理和利用的方案,进行了如下实验:取过滤后的水样200 g,逐滴加入稀盐酸至恰好不再产生气体为止,反应过程中生成气体与所加稀盐酸的质量关系如图所示。请回答下列问题(不考虑水样中杂质的影响):
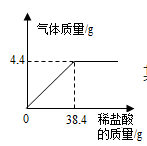
(1)反应生产CO2气体的质量是____g;
(2)反应后生成氯化钠的质量是多少?(请写出计算过程)
(3)农业上常用10%~20%的氯化钠溶液来选种。请通过列式计算判断:上述实验反应后所得溶液能否直接用于农业上选种?
(1)反应生产CO2气体的质量是4.4g;
(2)解:设反应后生成氯化钠的质量为x。
Na2CO3+2HCl===2NaCl+H2O+CO2↑
117 44
x 4.4 g
11744=x4.4 g x=117×4.4 g44=11.7 g
(3)反应后溶液中溶质的质量分数为:
11.7 g200 g+38.4 g-4.4 g×100%=5%<10%,故不能直接用于农业上选种。
某厂排放的废水中含有碳酸钠,易造成环境污染。化学兴趣小组为该厂设计废水处理和利用的方案,进行了如下实验:取过滤后的水样200 g,逐滴加入稀盐酸至恰好不再产生气体为止,反应过程中生成气体与所加稀盐酸的质量关系如图所示。请回答下列问题(不考虑水样中杂质的影响):

(1)反应生产CO2气体的质量是____g;
(2)反应后生成氯化钠的质量是多少?(请写出计算过程)
(3)农业上常用10%~20%的氯化钠溶液来选种。请通过列式计算判断:上述实验反应后所得溶液能否直接用于农业上选种?
100 g某浓度的硫酸恰好与13 g的锌完全起反应。请计算:
(1)生成氢气的质量(结果精确到0.1 g);
(2)反应后所得溶液中溶质的质量分数(写出计算过程,结果精确到0.1%)。
二氧化碳是导致温室效应的主要气体,也是一种宝贵的资源。用CO2和NH3来合成尿素[CO(NH2)2]是固定和利用CO2的成功范例,其反应的化学方程式为:
CO2+2NH3=====一定条件CO(NH2)2+H2O。
请计算下列问题:
(1)若用CO2和NH3生产900 t尿素,理论上可固定CO2的质量是多少吨?
(2)2 t含尿素90%的化肥(杂质不含N)中,含氮元素的质量是多少吨(精确到0.1 t)?
某地一辆满载浓硫酸的罐车翻倒,导致溶质质量分数为98%的浓硫酸20 t泄漏,并向路基两边蔓延。接到报警后消防官兵立即赶来并用石灰浆(主要成分为氢氧化钙)中和硫酸解除了险情。请回答:
(1)溶质质量分数为98%的浓硫酸20 t中含H2SO4的质量是____;
(2)计算中和泄漏的98%浓硫酸20 t,理论上需要氢氧化钙的质量。
在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化如下表所示。下列说法中不正确的是
物质 甲 乙 丙 丁
反应前物质质量/g 8 32 5 4
反应后物质质量/g 16 4 x 24
今年春季我国出现H7N9禽流感,治疗的新药是帕拉米韦,其分子式是C15H28N4O4,有关该物质的下列说法不正确的是
科学家经过多年研究证明,很多同学爱吃的某些小包装零食中,含一定量的有毒、有害、致病的化学物质。某些油炸食品中含有致癌物质丙烯酰胺,丙烯酰胺的化学式为C3H5ONx。回答下列问题:
(1)碳元素和氧元素的质量比是___(填最简整数比)。
(2)丙烯酰胺的相对分子质量为71,则x的数值为____。
我国民间有端午挂艾草的习俗。艾草含有丰富的黄酮素(化学式为:C15H10O2),有很高的药用价值。请回答:
(1)黄酮素属于____(填“有机”或“无机”)化合物。
(2)黄酮素含有____种元素,碳、氢的原子个数比为____(填最简化)。
(3)黄酮素分子中碳元素的质量分数为____(结果精确到0.1%)。
下图表示某些物质间转化关系(反应条件和部分产物已省略)。其中A、E为固体氧化物,且A为黑色粉末;B、D是由相同元素组成的无色液体,且B具有消毒杀菌作用;C是维持生命活动必不可少的无色气体;Y、Z为无色气体,其中Y有毒;X是最常见的金属。请回答下列问题:
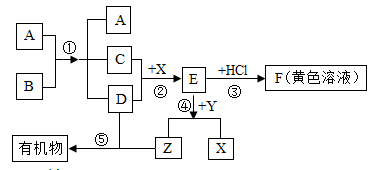
(1)反应①中A物质的作用是__;
(2)反应③的化学方程式__;
反应④的化学方程式__;
(3)日常生活中为了防止反应②的发生,可采取的措施是__(写一点即可)。
A、B、C、D是初中化学常见的物质,其转化关系如下图所示(部分产物略去):
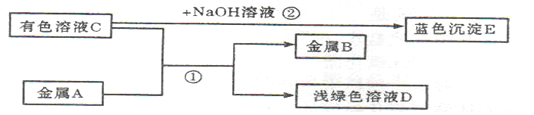
(1)向溶液C中加入BaCl2溶液,有白色沉淀产生,则溶液C中溶质的化学式为__;
(2)反应①中的化学方程式为_Fe+CuSO4===FeSO4+Cu_,该反应说明金属A的活动性比金属B的活动性__(填“强”或“弱”);
(3)反应②的基本反应类型是__;
(4)分离出反应②中蓝色沉淀的操作方法是__。