25.根据下列材料,按要求完成任务。
材料一《普通高中化学课程标准(实验)》关于“非金属及其化合物”的内容标准:通过实验了解氯、氮、硫、硅等非金属及其重要化合物的主要性质.认识其在生产中的应用和对生态环境的影响.?
材料二某版本教科书《化学l》的知识结构体系?
第一章从实验学化学?
第二章化学物质及其变化?
第三章金属及其化合物?
第四章非金属及其化合物?
第一节无机非金属材料的主角——硅?
第二节富集在海中的元素——氯?
第三节硫和氮的氧化物?
第四节氨硝酸硫酸?
材料三某版本高中实验教科书《化学1》中“活泼的黄绿色气体——氯气”的片段:?

氯气的发现和确认?

1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热.产生了一种黄绿色的气体,有强烈的刺鼻气味。舍勒对这种气体进行了研究,但他受当时流行的学说…一一燃素说(后来证明是错误的)的影响。未能确认这种气体的“庐山真面目”。后来的研究者又被当时得到广泛认同的“一切酸中舍有氧”的观点所束缚。认为舍勒制得的黄绿色气体是“氧化的盐酸”气——一一种氧化物。英国化学家戴维曾通过多种实验想把“氧化的盐酸”,中的“氧”夺取出来,但都未能实现。直到1810年,戴维以大量实验事实为根据,确认“氧化的盐酸”不是一种化合物,而是一种新元素组成的单质,他将这种元素命名为chlorine。这一名称来自希腊文.有“绿色”的意思。中文译名曾为“绿气”,后改为“氯.气.”。
图4-14?瑞典化学家——舍勒(C.?W..Seheele.?1742——1786)

阅读科学史话“氯气的发现和确认”.并思考:?
1.从氯气的发现到确认为一种新的元素.时间长达三十多年。你从这一史实中得到什么启示?
2.舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。请写出舍勒发现氯气的化学反应方程式:?
氯气(Cl2)在通常情况下呈黄绿色,是一种有强烈刺激性气味的有毒气体。与其他气体一样,氯气在低温和加压的条件下可以转变为液态(称为液氯)和固态。氯气是很活泼的非金属单质,具有很强的氧化性。氯气能与大多数金属化合。生成金属氯化物(盐)。例如.钠、铁、铜等都能在氯气中燃烧:?
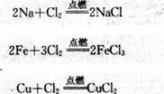
氯气也能与大多数非金属化合。

实验4-3
在空气中点燃H2.然后把导管缓缓伸入盛满氯气的集气瓶中。观察现象。

H2与Cl2化合的产物HCl气体溶于水,就成为我们常用的盐酸。
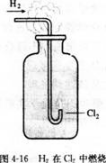

目前,很多自来水厂用氯气来杀菌、消毒,我们偶尔闻到的自来水散发出来的刺激性气味就是余氯的气味。
氯气溶于水为什么能杀菌消毒呢?在25℃时.1体积的水可溶解约2体积的氯气.氯气的水溶液称为氯水。在常温下,溶于水中的部分Cl2与水发生如下反应:
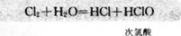
次氯酸(HClO)具有强氧化性,因此。次氯酸能杀死水中的病菌.起到消毒的作用。
氯水也因为含有次氯酸而具有漂白作用。
次氯酸是很弱的酸,不稳定,只存在于水溶液中,在光照下易分解放出氧气:?

近年来有科学家提出,使用氯气对自来水消毒时,氯气会与水中的有机物发生反应,生成的有机氯化物可能对人体有害。因此.人们已开始研究并试用新的自来水消毒剂,如二氧化氯(ClO2)、臭氧等。

氨水的漂白作用?
将有色纸条或布条、有色花瓣放入盛有1/3容积新制氯水的广口瓶中.盖上玻璃片。
观察现象。


干燥的氯气能否漂白物质?
持有色纸条或布条、有色花瓣放入盛满于燥氯气的集气瓶中,盖上玻璃片。观察现象。
 ?
?
最初,人们直接用氯气作漂白剂,但因氯气的溶解度不大.而且生成的HClO不稳定,难以保存,使用起来很不方便,效果也不理想。在Cl2与水反应原理的基础上,经过多年的实验、改进,才有了今天常用的漂白液和漂白粉。
在常温下.将氯气通人NaOH溶液中可以得到以次氯酸钠(NaCIO)为有效成分的漂白液。其化学反应方程式如下:?


氯气是一种有毒气体。但可用于自来水的杀菌消毒:使用氯气对自来水消毒时可能产生一些负面影响。因此,人们开始研究并试用一些新型自来水消毒剂。从中你得到什么启示?
要求:?
(1)简要分析教材中该内容的地位和作用。
(2)写出本课的三维教学目标。
(3)设计本节内容的教学过程。