20.铜及其化合物在生活、生产中用途广泛。
(1)以氧化铜为原料制取铜。
某研究小组为探究CO的还原性,设计了如下系列实验。
实验1:将CuO加水制成糊状,刷在试管内壁,在试管底部加入炭粉,再向试管中通入CO2(见图甲),集满后立即用气球密封。
实验2:用酒精灯加热CuO部位(见图乙),无明显现象。
实验3:用加网罩的酒精灯加热炭粉(见图丙);一段时间后,利用CO2传感器测得试管内CO2含量变小。
实验4:加热CuO(见图丁),黑色固体变成紫红色。
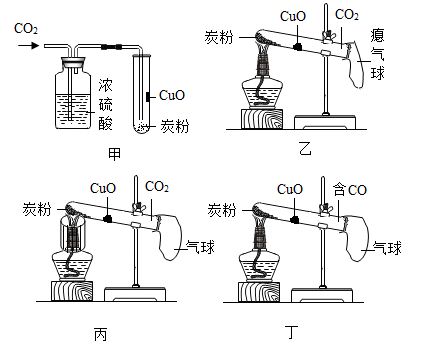
①实验1中浓硫酸的作用是 ;
②实验2得到的结论是 ;
③实验3的目的是 ,酒精灯加网罩的作用是 ;
④写出实验4中发生反应的化学方程式:。
(2)以辉铜矿(主要成分为Cu2S)为原料冶炼铜。
方法1:火法炼铜.Cu2S在高温下与氧气反应的部分转化关系如图:
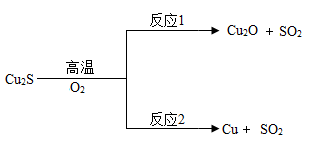
①Cu2O中铜元素的化合价为 ;
②反应2的基本类型是 ;
方法2:生物炼铜。Cu2S在酸性环境和微生物菌类的作用下转化为CuSO4的原理是Cu2S+O2+2H2SO4═2CuSO4+2H2O+X。
③X的化学式为 ;
④从含有CuSO4和H2SO4的混合溶液中回收铜,请补充完整实验方案。
步骤1:向一定量的混合溶液中加入过量的试剂Y,过滤,得到滤渣和滤液1。
步骤2:取步骤1中的滤渣,,过滤,得到Cu和滤液2。
步骤3:将滤液1与滤液2合并,冷却结晶,得到FeSO4•7H2O晶体。
写出步骤1中发生反应的化学方程式:(任写1个)。